
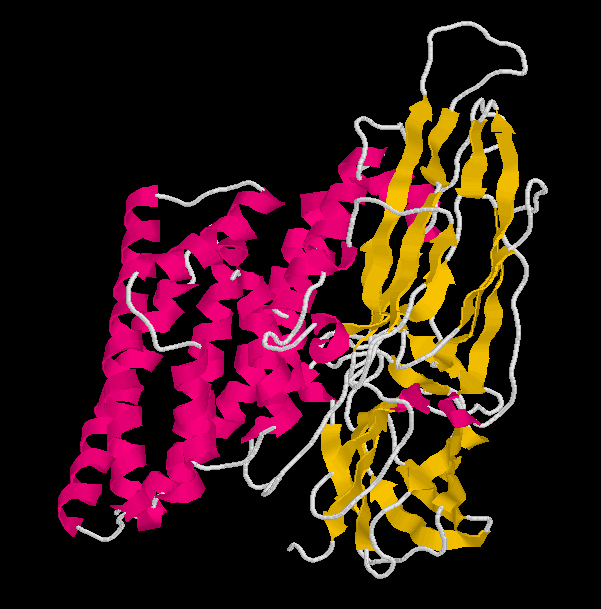
Cristales de toxina de Bacillus thuringiensis serovar morrisoni strain T08025. Fotografía de Jim Buckman
|
BIOQUIMICA DE LOS ALIMENTOS Miguel Calvo |







 Volver a Bioquímica de los Alimentos
Volver a Bioquímica de los Alimentos
 Volver a: Fundamentos de los alimentos transgénicos
Volver a: Fundamentos de los alimentos transgénicos