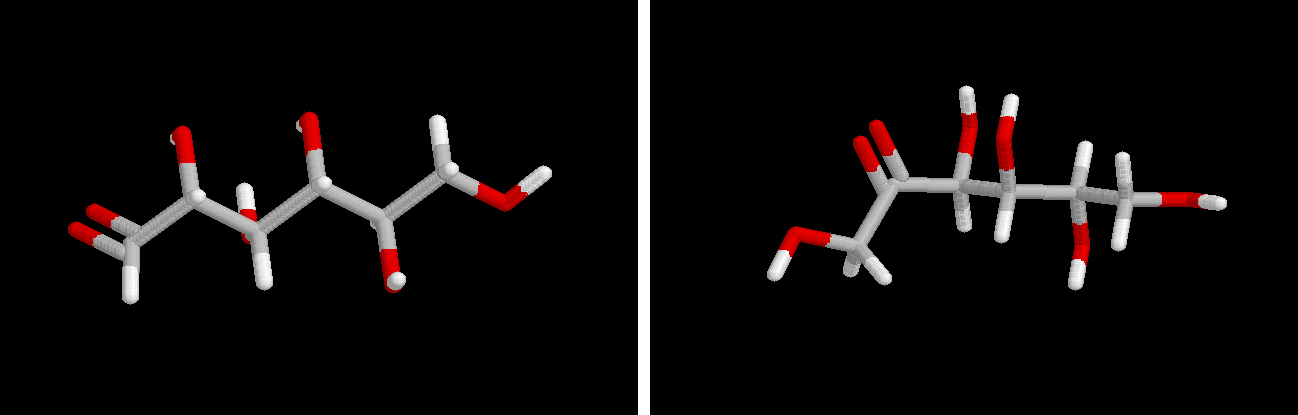
Glucosa y fructosa representadas en sus formas abiertas.
Debe hacerse notar la diferencia en la posición del grupo carbonilo, en un extremo de la cadena en la glucosa (aldosa) y dentro de ella en la fructosa (cetosa)
|
BIOQUIMICA DE LOS ALIMENTOS Miguel Calvo |

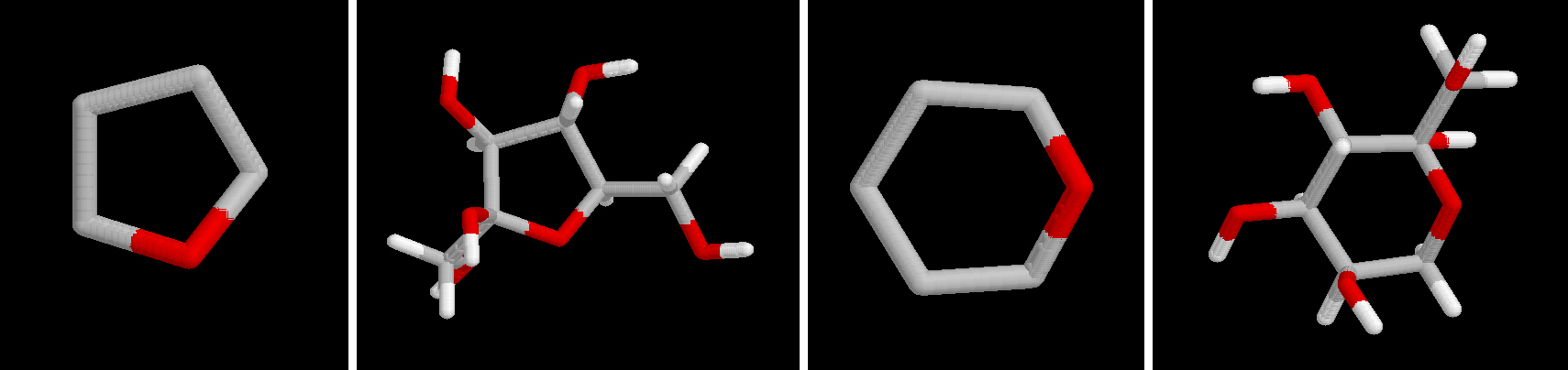
| a-glucosa | b -glucosa | Equilibrio | |
| Rotación específica | 112,0 | 18,7 | 52,7 |
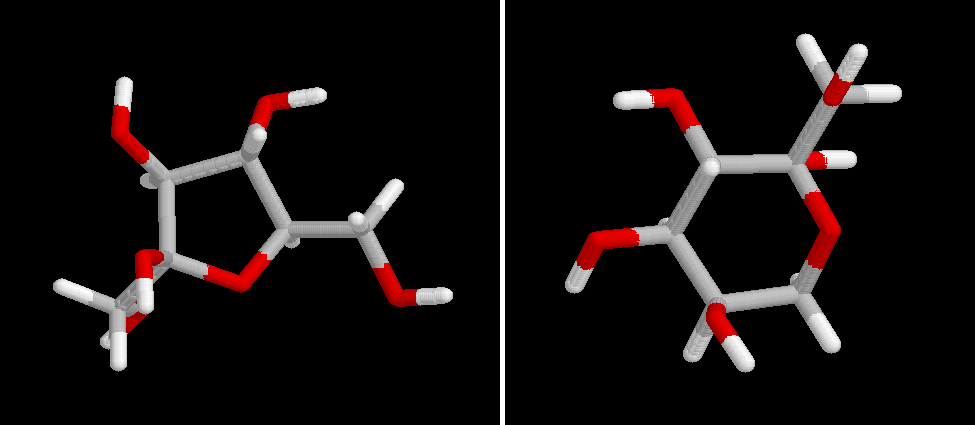
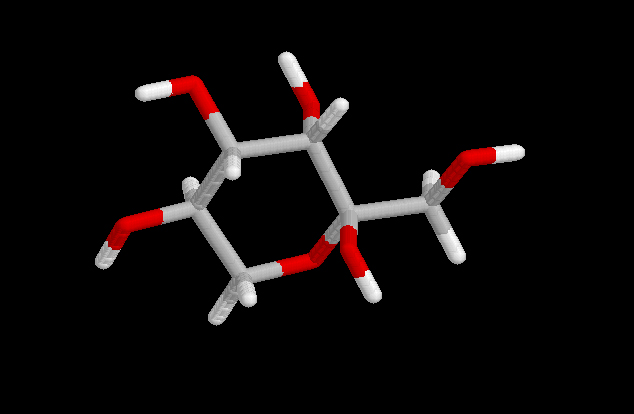
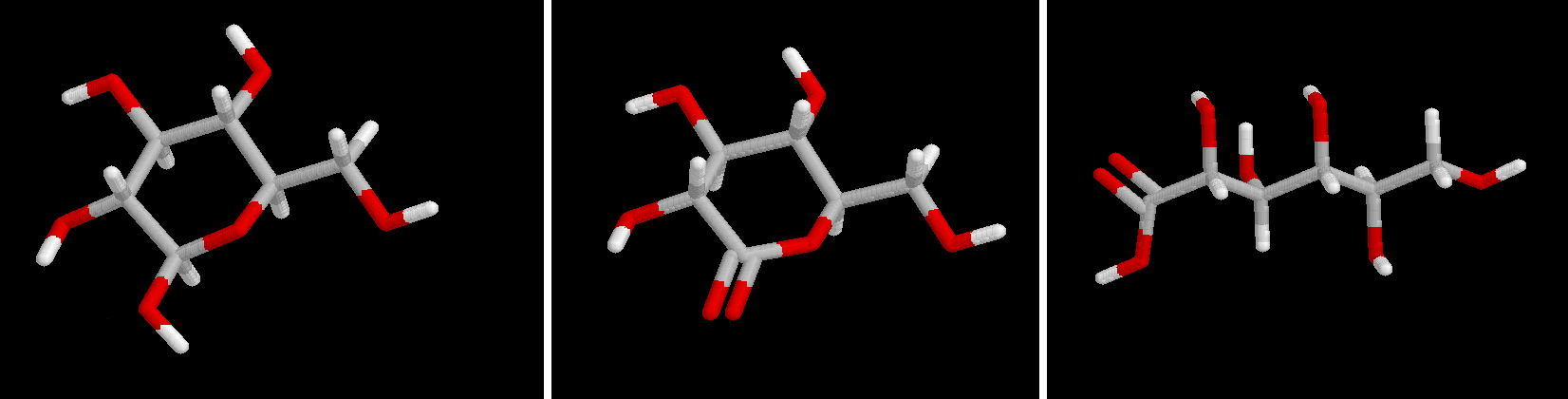
 Volver a Bioquímica de los Alimentos
Volver a Bioquímica de los Alimentos
 Volver a Monosacáridos y oligosacáridos
Volver a Monosacáridos y oligosacáridos