|
BIOQUIMICA DE LOS ALIMENTOS
Miguel Calvo
|
CONSERVANTES
CONSERVANTES
Introducción
La causa fundamental de alteración de los alimentos, y el factor que limita la vida útil de muchos de ellos, son los microrganismos (bacterias, levaduras y mohos). El problema del deterioro microbiano de los alimentos tiene implicaciones económicas evidentes, tanto para los fabricantes (deterioro de materias primas y productos elaborados antes de su comercialización, pérdida de la imagen de marca, etc.) como para distribuidores y consumidores (deterioro de productos después de su adquisición y antes de su consumo). Se calcula que más del 20% de todos los alimentos producidos en el mundo se pierden por acción de los microorganismos.
Por otra parte, los alimentos alterados pueden resultar muy
perjudiciales para la salud del consumidor. La toxina botulínica, producida por
la bacteria Clostridium botulinum en las conservas mal esterilizadas,
embutidos y en otros productos, es una de las substancias más venenosas que se conocen (miles de veces más tóxica que el cianuro). Las aflatoxinas,
producidas por el crecimiento de ciertos mohos, son potentes agentes
cancerígenos.
Existen pues razones poderosas para evitar la alteración de los
alimentos. A los métodos físicos, como el calentamiento, deshidratación,
irradiación o congelación, pueden asociarse métodos químicos que causen la
muerte de los microrganismos o que al menos eviten su crecimiento.
En muchos alimentos existen de forma natural substancias con actividad antimicrobiana. Muchas frutas contienen diferentes ácidos orgánicos, como el ácido benzoico o el ácido cítrico. La larga estabilidad de los yogures comparados con la leche se debe al ácido láctico producido durante su fermentación. Los ajos, cebollas y muchas especias contienen agentes antimicrobianos, o precursores que se transforman en ellos al triturarlos.
Los organismos oficiales correspondientes, a la hora de autorizar el uso de un conservante alimentario, tienen en cuenta que éste sea un auxiliar del procesado correcto de los alimentos y no un agente para enmascarar unas condiciones de
manipulación sanitaria o tecnológicamente deficientes, ni un sistema para
defraudar al consumidor engañandole respecto a la frescura real de un alimento.
Las condiciones de uso de los conservantes están reglamentadas estrictamente en todos los paises del mundo. Usualmente existen límites a la cantidad que se puede añadir de un conservante y a la de conservantes totales. Los conservantes alimentarios, a las concentraciones autorizadas, no matan en general a los microorganismos, sino que solamente evitan su proliferación. Por lo tanto, solamente son útiles con materias primas de buena calidad.
Ácido orgánicos
Un buen número de conservantes son ácidos orgánicos débiles, eficaces sobre todo en alimentos ácidos en los que se enceuntran en una proporción importante en forma no ionizada. Esto permite su entrada en los microrganismos, a través de la
El interior de las células bacterianas y de los mohos y levaduras tienen un pH próximo a la neutralidad, lo que hace que el ácido orgánico se disocie, libere iones H+ y acidifique el medio. Esto perturba el metabolismo microbiano, y tiene como consecuencia un descenso de la concentración de ATP, bien sea por interferencia con los enzimas que lo producen o bien por el consumo inducido por el bombeo de los iones H+ al exterior.
Acido sórbico y sorbatos
El ácido sórbico es un ácido graso diinsaturado, el ácido trans,trans-2,4-hexadienoico. Actualmente, en forma de ácido o como sorbatos, es el conservante más utilizado por la industria alimentaria. La razón principal es su falta de toxicidad, además de que su uso no aporta sabores ni aromas extraños al alimento. Los sorbatos son muy poco tóxicos, de los que menos de entre todos los conservantes, menos incluso que la sal común o el ácido acético (el componente activo del vinagre). Por esta razón su uso está autorizado en todo el mundo. Metabólicamente el ácido sórbico se comporta en el organismo como los demás ácidos grasos, es decir, se absorbe y se utiliza como una fuente de energía.
El ácido sórbico se encuentra en forma natural en las bayas inmaduras del arbol conocido como “serbal de cazadores”, Sorbus aucuparia, de la familia de las Rosáceas, de donde fue obtenido inicialmente, y de donde procede su nombre.

Frutos de serbal de cazadores, Sorbus aucuparia
Por cortesía de Paul Buselen Katholieke Universitiet Leuven Plantengids
El ácido sórbico fue sintetizado hacia 1900, pero permaneció como un compuesto sin aplicaciones prácticas hasta que se descubrieron sus propiedades antimicrobianas, en la década de 1940.
Generalmente se utilizan en la industria alimentaria los sorbatos, que tienen la ventaja de que son más fácilmente solubles que el ácido sórbico. Su pK a es 4.76. Dado que la forma activa como antimicrobiano es la molécula no disociada, puede utilizarse en alimentos hasta pH 6 como máximo, aunque su eficacia es mayor cuanto menor sea el pH.
En la unión Europea les corresponden los siguientes códigos en la lista de aditivos:
E-200 Acido sórbico
E-201 Sorbato sódico
E-202 Sorbato potásico
E-203 Sorbato cálcico
Ácido sórbico
Sus principales inconvenientes son que el ácido sórbico y los sorbatos son comparativamente caros, y que se pierden en parte cuando el producto se somete a ebullición. Son también algo sensibles a la oxidación.
El ácido sórbico y los sorbatos son conservantes especialmente eficaces contra los mohos y levaduras, y menos contra las bacterias, aunque existen diferencias entre especies. No se conoce bien el mecanismo de acción, y hasta el momento no se ha detectado la aparición de cepas “resistentes”.
Los sorbatos se utilizan muy ampliamente, especialmente para la protección contra mohos en repostería y pastelería, aunque en estos casos es necesario utilizarlos a concentraciones más bajas, para no afectar a las levaduras responsables de la fermentación. En algún caso, se prescinde por ello de las levaduras biológicas, utilizando levaduras químicas. También se utilizan los sorbatos en derivados cárnicos y en quesos, en bebidas refrescantes, aceitunas en semiconserva, en postres lácteos con frutas, en mantequilla, margarina, mermeladas y en otros productos. En la industria de fabricación de vino es útil como inhibidor de la fermentación secundaria, permitiendo reducir los niveles de sulfitos.
Acido propiónico
La utilización del ácido propiónico como conservante se patentó ya en 1939. El ácido propiónico es activo contra mohos, y también contra contra algunas bacterias concretas, incapaces de metabolizar un ácido graso con tres carbonos, por lo que se acumula en sus células, compitiendo con los sustratos del los enzimas. La más interesante de estas últimas es el Bacillus mesentericus, responsable de una alteración característica del pan y de la repostería, conocida como “pan filante”.
El ácido propiónico se encuentra de forma natural a concentraciones de hasta el 1% en algunos quesos, producido por la acción de Propionibacterium.
Ácido propiónico
Como los demás conservantes, para ser útil debe estar en forma no disociada, es decir, en medio ácido, aunque es útil hasta pH de alrededor de 5,5. Entre sus ventajas se enceuntra en hecho de que es muy barato. El principal inconveniente del ácido propiónico es su olor, muy intenso, mezcla de acidez y olor a “queso pasado”. Se utilizan sobre todo sus sales, ya que el ácido (caústico, volátil y extremadamente maloliente) es difícil de manejar.
Según la regulación legal de la Unión Europea, al ácido propiónico y a sus sales les corresponden los siguientes códigos como aditivos alimentarios:
Acido propiónico, E 280
Propionato sodico, E 281
Propionato cálcico, E 282
Propionato potásico, E 283
Acido láctico
El ácido láctico es un caso especial, ya que aunque se utiliza relativamente poco como aditivo alimentario, es muy importante en la conservación de diversos alimentos, en los que se produce mediante fermentaciones microbianas. Tiene actividad conservante solamente a concentraciones relativamente elevadas, por encima del 0,5%, especialmente contra bacterias anaerobias.
Ácido láctico
Según la regulación legal de la Unión Europea, al ácido láctico le corresponde el código de aditivos alimentario E 270 . Habitualmente se utiliza mezclado con otros conservantes.
Acido benzoico
El ácido benzoico se descubrió en el siglo XVII en la resina benjuí, o “incienso de Java”, pero no fue estudiado en detalle hasta mediados del siglo XVIII. La palabra castellana benjuí procede precisamente del nombre original de esta resina, luban jawi. Del castellano benjuí paso al francés como benjoin, y al alemán e italiano como benzoin. Al aislar y estudiar Scheele el ácido, le llamó por ello ácido benzoico. El hidrocarburo obtenido en 1833 por destilación del ácido benzoico se llamó inicialmente benzina (bencina), y luego benceno.
El ácido benzoico se encuentra también de forma natural en la canela, en las ciruelas y especialmente en los camemoros, un tipo de grosella muy popular en los países nórdicos (incluso aparece en el reverso de la moneda de dos euros de Finlandia). En este caso, el contenido natural de ácido benzoico en esta fruta es incluso superior al que se podría utilizar legalmente si se empleara como aditivo.

Fruto de camemoro, Rubus chamaemorus
Fotografía del Dr. Robert Thomas y de Margaret Orr. © California Academy of Sciences. Por cortesía de The Manzanita Project
El ácido benzoico es un conservante activo en medio ácido, generalmente por debajo de pH 5, y en algunas especies solamente por debajo de pH 4. Es útil contra bacterias, mohos y levaduras, especialmente contra levaduras. Llega a inhibir el crecimiento de algunas especies con concentraciones de solamente 0,01%, pero generalmente son necesarias concentraciones superiores. Actúa inhibiendo el metabolismo del acetato y la fosforilación oxidativa. Es un conservante barato.
Su principal inconveniente es que presenta una cierta toxicidad, por lo que se utiliza cada vez menos, y solamente en productos de consumo ocasional. La ADI fijada por la FAO en 1996 es de 5 mg/Kg. El ácido benzoico se elimina en la orina en forma de ácido hipúrico, conjugado con glicina.
Ácido benzoico
Parabenos
Los parabenos son ésteres del ácido para-hidroxibenzoico con metanol, etano o propanol. Se utilizan en la conservación de alimentos desde la década de 1930. Su principal ventaja es que, al no tener grupos fácilmente ionizables, su comportamiento es prácticamente independiente del pH en un rango muy amplio, entre 3 y 8, al contrario que otros conservantes alimentarios, que solamente son eficaes en medio ácido. Los derivados sódicos se forman a partir de la ionización del hidrógeno del grupo fenólico. Estos derivados son algo más fáciles de manejar que los parabenos como tales, pero se transforman en ellos en los alimentos.
En la unión Europea les corresponden los siguientes códigos en la lista de aditivos:
E 214 Para-hidroxi-benzoato de etilo (éster etílico del ácido para-hidroxi- benzoico)
E 215 Derivado sódico del éster etílico del ácido para-hidroxi- benzoico
E 216 Para-hidroxi-benzoato de propilo (éste propílico del ácido para-hidroxi-benzoico)
E 217 Derivado sódico del éster propílico del ácido para-hidroxi-benzoico
E 218 Para-hidroxi-benzoato de metilo (éster metílico del ácido para-hidroxi-benzoico)
E 219 Derivado sódico del éster metílico del ácido para-hidroxi-benzoico
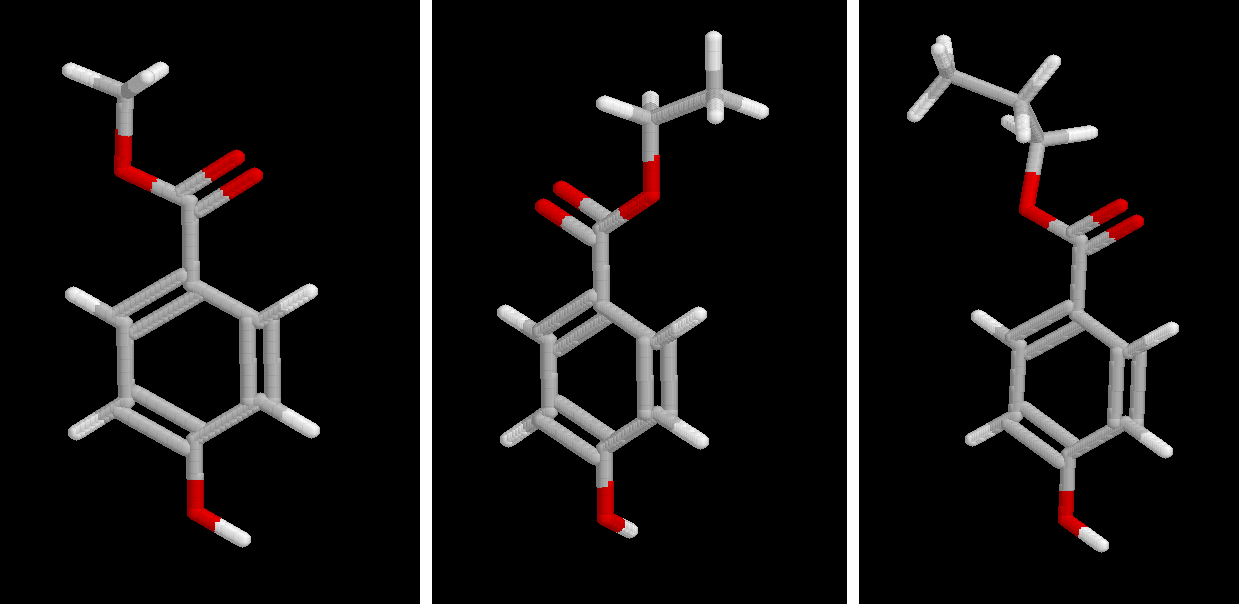
Metilparabeno, etilparabeno y propilparabeno
Los parabenos son conservantes efectivos frente a mohos y levaduras, y bastante menos frente a bacterias. Su actividad conservante aumenta con la longitud de la cadena, disminuyendo a la vez la solubilidad, aunque su efecto concreto depende del tipo de microrganismo. Comparativamente, el metil parabeno es más eficaz contra mohos, mientras que el propil barabeno lo es contra levaduras.
Su mecanismo de actuación no se conoce con precisión, pero parece estar relacionado con su inclusión en la membrana celular, dando lugar a perturbaciones en su permeabilidad.
Estos conservantes tienen un sabor fenólico característico, especialmente el ester metílico, incluso a dosis menores de los límites legales, lo que limita su uso. Se utilizan fundamentalmente para la protección de derivados cárnicos, especialmente los tratados por el calor, conservas vegetales y productos grasos, repostería, y en salsas de mesa.
Los parabenos se utilizan como conservantes alimentarios en muchos paises. Desde los años 50 se han realizado múltiples estudios acerca de su posible toxicidad, demostrandose que son relativamente poco tóxicos, menos que el ácido benzoico. Se absorben rápidamente en el intestino, eliminándose también rápidamente en la orina, sin que se acumulen en el organismo. Algunas de las personas alérgicas a la aspirina también pueden ser sensibles a estos aditivos.
Otros ácidos orgánicos
Según la regulación legal de la Unión Europea, tienen también la consideración legal de conservantes los siguientes ácidos orgánicos y sus sales
Acido acético, E 260
Acetato potásico, E 261
Acetato sodico, E 262
Dicetato sódico, E 262ii
Acetato cálcico, E 263
Acido málico, E 266
Acido fumárico, E 267
El ácido acético es el constituyente fundamental del vinagre, del que representa alrededor del 4%. Como tal solución ácida se utiliza ampliamente, más como ingrediente general, modificando todas las propiededes del alimento, que como simple conservante. Las sales se utilizan en panadería y repostería, para controlar la proliferación de mohos sin interferir con las levaduras. Como en los demás ácidos orgánicos, su eficacia como conservante es tanto mayor cuanto menor sea el pH. En el caso de los otros ácidos orgánicos, su interés y utilización como conservantes alimentarios son extremadamente limitados.
Anhidrido sulfuroso y sulfitos
El anhidrido sulfuroso, SO2, obtenido quemando azufre, se utiliza como conservante y desinfectante en la industria del vino al menos desde la época romana.
La forma química en la que se encuentra depende de las condiciones del medio (presencia de agua, pH, concentración), no de la forma en la que se haya añadido, modificándose mediante una serie de reacciones químicas que dan lugar a distintos equilibrios.
SO2 + H2O ←-→ SO3H2 ←-→ SO3H- + H+ ←-→ SO32- + 2 H+
A pH superior a 7, su efectividad es muy pequeña. En cambio, a pH por debajo de 3 su efectividad es máxima, ya que predomina la forma no ionizada, SO3H2.
A pH intermedios, que son los más habituales en los alimentos, suele predominar la forma parcialmente ionizada, el ion bisulfito (o sulfito ácido) SO3H-.
El bisulfito solamente puede existir como tal en disolución. En forma sólida se tiene realmente el metabisulfito (S2O5Na2, en el caso del metabisulfito sódico)
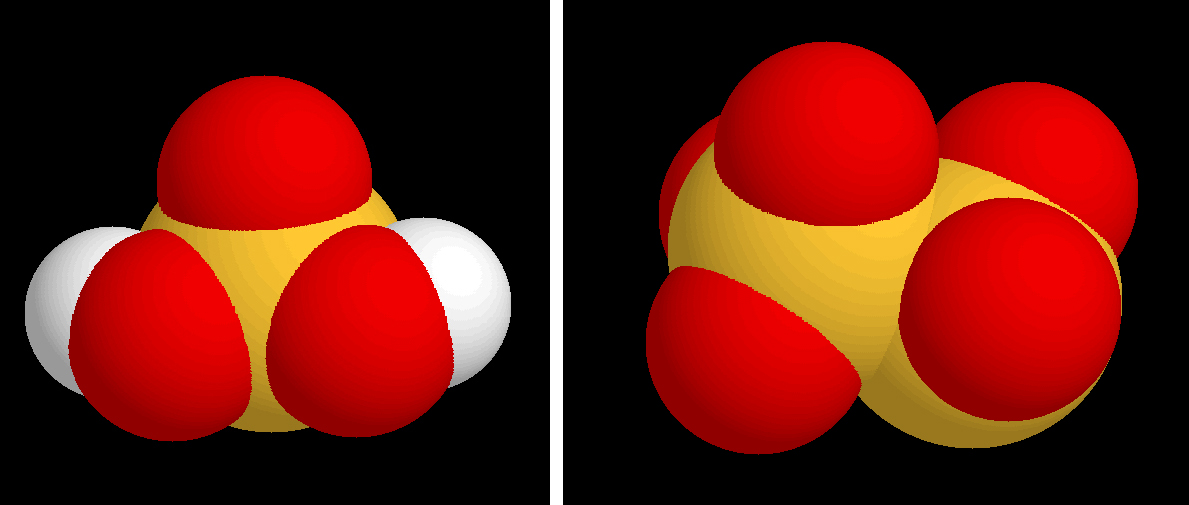
Ácido sulfuroso y metabisulfito
Según la lista de códigos de aditivos alimentarios de la Unión Europea, les corresponden los siguientes:
Anhidrido sulfuroso, E 220
Sulfito sódico, E 221
Sulfito ácido de sodio, bisulfito sódico, E 222
Metabisulfito sódico E 223
Metabisulfito potásico E 224
Sulfito cálcico E 226
Sulfito ácido de calcio, E 227
Sulfito ácido de potasio, E 228
Además de cómo conservante, el sulfuroso y los sulfitos actúan en los alimentos inhibiendo el pardeamiento enzimático, algunas etapas de la reacción de Maillard, y como antioxidantes (pasando ellos de sulfito a sulfato). En la carne picada mantienen el color de la mioglobina, pero esta última aplicación no está generalmente autorizada.
Desafortunadamente tienen varios inconvenientes, lo que limita mucho su uitilización. Desde el punto de vista nutricional, los sulfitos destruyen la tiamina, por lo que no deberían utilizarse en alimentos que sean una fuente importante de esta vitamina, como la carne.
El sulfito es también relativamente tóxico. En ingerido se metaboliza oxidándose a sulfato, que se elimina a través de la orina. Sin embargo, el principal problema es que un pequeño porcentaje de las personas asmáticas son extremadamente sensibles al anhidrido sulfuroso, de tal modo que en algunos casos incluso unos pocos miligramos pueden producirles crisis asmáticas. Por esta razón, el etiquetado de los alimentos que contengan sulfuroso debe ser especialmente cuidadoso.
Sus aplicaciones fundamentales, para las que resulta prácticamente insustituible, son la elaboración de derivados de vegetales y la industria del vino.
Nitratos y nitritos
Los nitratos, particularmente el nitrato potásico (salitre), se han utilizado en el curado de los productos cárnicos desde la época romana. Probablemente su efecto se producía también con la sal utilizada desde al menos 3.000 años antes, que, procedente en muchos casos de desiertos salinos, solía estar impurificada con nitratos.
Nitratos y nitritos son muy importantes en productos cárnicos como conservantes y también para obtener los colores típicos de los productos cárnicos curados y cocidos.
El componente activo es en todos los casos el nitrito. El nitrato se transforma en él por reducción, catalizada por enzimas de bacterias de la flora de maduración.
NO3- ----→ NO2-
Sin embargo, añadiendo nitratos, nitritos o, como se hace habitualmente, una mezcla de los dos se puede controlar el efecto en el tiempo. El nitrito es bastante inestable, por lo que si añade una dosis inicial baja, es necesario mantener la concentración con el que se forma a partir del nitrato. Si no, desaparecería pronto, perdiéndose el efecto protector, o sería necesario añadir inicialmente una dosis mayor, más peligrosa.
El efecto del curado, en el que participa también la sal y las especias es conseguir la conservación de la carne evitando su alteración y mejorando el color. El color de curado se forma por una reacción química entre el pigmento de la carne, la mioglobina , y el ión nitrito.
En la unión Europea les corresponden los siguientes códigos en la lista de aditivos:
E-249 Nitrito potásico
E-250 Nitrito sódico
E-251 Nitrato sódico
E-252 Nitrato potásico
El uso de nitratos y nitritos como aditivos presenta incuestionablemente ciertos riesgos. El primero es el de la toxicidad aguda. El nitrito es tóxico (2 gramos pueden causar la muerte una persona), al ser capaz de unirse a la hemoglobina de la sangre, de una forma semejante a como lo hace a la mioglobina de la carne, formándose metahemoglobina, un compuesto que ya no es capaz de transportar el oxígeno. Esta intoxicación puede ser mortal, y de hecho se conocen varios casos fatales por ingestión de embutidos con cantidades muy altas de nitritos, producidas localmente por un mal mezclado del aditivo con los otros ingredientes durante su fabricación. Para evitar esto, se puede utilizar el nitrito ya mezclado previamente con sal. En muchos paises, esto debe hacerse obligatoriamente y las normativas de la CE incluyen esta obligatoriedad.
Los niños son mucho más susceptibles que los adultos a esta intoxicación, por su menor cantidad de hemoglobina, y en el caso de los muy jóvenes, por la pervivencia en su sangre durante un cierto tiempo despues del nacimiento de la forma fetal de la hemoglobina, aún más sensible al efecto de los nitritos.
Otro riesgo del uso de nitratos y nitritos es la formación de nitrosaminas, substancias que son agentes cancerígenos. Existen dos posibilidades de formación de nitrosaminas: en el alimento o en el propio organismo. En el primer caso, el riesgo se limita a aquellos productos que se calientan mucho durante el cocinado (bacon, por ejemplo) o que son ricos en aminas nitrosables (pescado y productos fermentados). En el segundo caso se podrían formar nitrosaminas en las condiciones ambientales del estómago.
La discusión del uso de nitratos se complica porque estos deben transformarse en nitritos tanto para su acción como aditivo como para su actuación como tóxico o como precursor de agentes cancerígenos. Esta transformación se produce por la acción de microorganismos, ya sea en los alimentos o en el interior del organismo. En este último caso, solo puede producirse en la boca, ya que en el intestino, salvo casos patológicos, se absorbe rápidamente sin que haya tiempo para esta transformación. En la boca, los nitratos pueden proceder del alimento o aparecer en la saliva, recirculados después de su absorción. Los nitratos no recirculados (la mayoría) se eliminan rápidamente por la orina.
Se conocen afortunadamente una serie de técnicas para disminuir el riesgo de formación de nitrosaminas. En primer lugar, obviamente, reducir la concentración de nitritos y nitratos siempre que esto sea posible. Debe tenerse en cuenta que la cantidad de nitritos que llega al consumidor es siempre mucho menor que la añadida al producto, ya que estos son muy inestables y reactivos.
En segundo lugar, se pueden utilizar otros aditivos que bloqueen el mecanismo químico de formación de nitrosaminas. Estos aditivos son el ácido ascórbico y sus derivados, y los tocoferoles, especialmente eficaces en medios acuosos o grasos, respectivamente. Se utiliza con mucha frecuencia, y en algunos paises (USA, por ejemplo) el empleo de ácido ascórbico junto con los nitritos es obligatorio.
Los riesgos tanto de toxicidad aguda como de formación de carcinógenos permitirían cuestionar radicalmente en uso de nitratos y nitritos en los alimentos, de no ser por un hecho conocido solo desde los años cincuenta. Los nitritos son un potente inhibidor del crecimiento de Clostridium botulinum, que, aunque no es patógena, produce durante su desarrollo una proteína, la toxina botulínica, que, como ya se indicó, es extremadamente tóxica (una dosis de entre 0,1 y 1 microgramo puede causar la muerte de una persona). La intoxicación botulínica o botulismo se debe al consumo de productos cárnicos, pescado salado (sobre todo en Japón) o conservas caseras mal esterilizadas en las que no se han destruido las esporas de esta bacteria. El riesgo de los productos cárnicos es conocido desde antiguo (la palabra botulismo procede del latín botulu, que significa embutido) ya que, aunque la toxina se destruye por calentamiento a unos 80o C, muchos productos de este tipo se consumen crudos.
También se podrían utilizar los nitratos en ciertos tipos de queso (Gouda y Mimolette), para evitar un hinchamiento excesivo durante su maduración. Este defecto está causado por un microorganismo emparentado con el causante del botulismo, pero inofensivo para la salud. No obstante, este tratamiento se usa muy poco, ya que el suero de quesería queda enriquecido en nitratos y es entonces muy dificilmente utilizable para obtener subproductos, además de altamente contaminante para el medio ambiente.
Los nitratos son constituyentes naturales de alimentos de origen vegetal, pudiendo encontrarse en ellos en concentraciones elevadas. Las espinacas o el apio, por ejemplo, pueden contener de forma natural más de 2 g/Kg de nitrato (10 veces más que la concentración máxima autorizada como aditivo ). Los nitratos también pueden estar presentes en otras verduras, como la remolacha o acelga, o en el agua de bebida. Los nitritos se encuentran en concentraciones muchísimo menores, excepto en productos vegetales alterados por microrganismos. No obstante, debe tenerse en cuenta que la eliminación de los nitritos como aditivos no los excluye ni mucho menos del organismo. Mientras que usualmente se ingieren menos de 3 mg/día en los alimentos, se segregan en la saliva del orden de 12 mg/día, y las bacterias intestinales producen unos 70 mg/día.
El caso de los nitritos y nitratos puede ser representativo de las decisiones basadas en la relación riesgo/beneficio. Por una parte, se situa el riesgo de la formación de nitrosaminas, potenciales cancerígenos, mientras que por otra se sitúa el beneficio de la evitación del botulismo. Con medidas complementarias, como la restricción de los niveles y el uso de inhibidores de la formación de nitrosaminas, los organismos reguladores de todos los paises aceptan el uso de nitratos y nitritos como aditivos, considerándolos necesarios para garantizar la seguridad de ciertos alimentos.
Nisina
La nisina es un antibiótico polipeptídico producido por la bacteria Lactococcus lactis. La existencia de esta substancia se conoce desde finales de la década de 1920, aunque se caracterizó mucho después. Se utiliza desde la década de 1940, aunque de forma muy limitada. Es un conservante bastante efectivo contra las bacterias gram-positivas, ya que se une a sus membranas interfiriendo en sus sistemas de transferencia de protones. En particular, se podría utilizar para combatir a varios microrganismos patógenos, como Clostridium botulinum y Bacillus cereus, que forman endoesporas que resisten mejor el calentamiento que las células vegetativas y también Listeria monocytogenes. La nisina es también es muy eficaz en la prevención de alteraciones del queso, mespecialmente quesos fundidos, producidas por Clostridia. Actualmente, esta es su principal aplicación.
La cadena polipeptídica de la nisina está formada por 34 aminoácidos, y tienen un peso molecular de 3354. Entre estos aminoácidos se encuentran varios poco comunes, como la lantionina, metilantionina, dehidroalanina y ácido dehidroaminobutírico. Todos ellos se forman por modificación de aminoácidos comunes (serina y treonina), después de la síntesis ribosomal del polipéptido. Tiene cuatro anillos, formados por un puente tioéter del tipo de la lantionina.
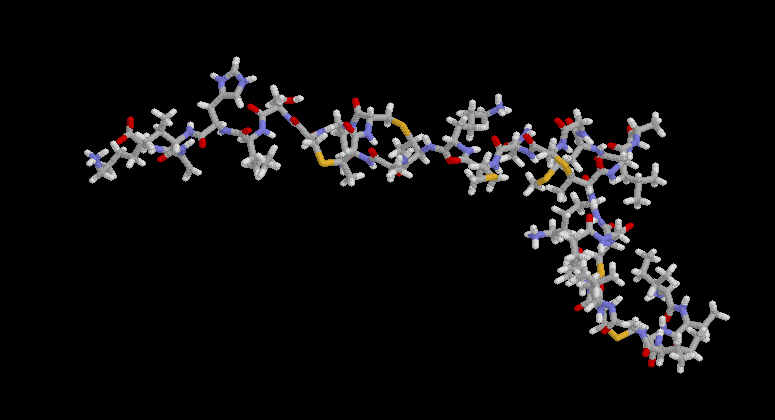
Nisina
La nisina es bastante resistente a los tratamientos térmicos, especialmente en medio ácido, a pH menor de 3,5. Se obtiene por fermentación, y su principal inconveniente es que es un conservante comparativamente caro, lo que limita su utilización. En el tubo digestivo se degrada como las demás proteínas. Como aditivo alimentario, en la Unión Europea tiene el código E 234.
Natamicina
La natamicina, o pimaricina, es un antibiótico macrolido, es decir, con un gran anillo de lactona, obtenido en 1955 a partir del microrganismo Streptomyces natalensis. El nombre de “natamicina” procede del de este microrganismo. El de “pimaricina” procede de la ciudad de Pietermaritzburg, donde se obtuvo la muestra de suelo de la que se aisló esta bacteria. Posteriormente se obtuvo a partir de otros microrganismos semejantes, recibiendo los nombres de “tennecetina” y “myprozina”. Normalmente se comercializa bajo la marca registrada “Delvocid”.
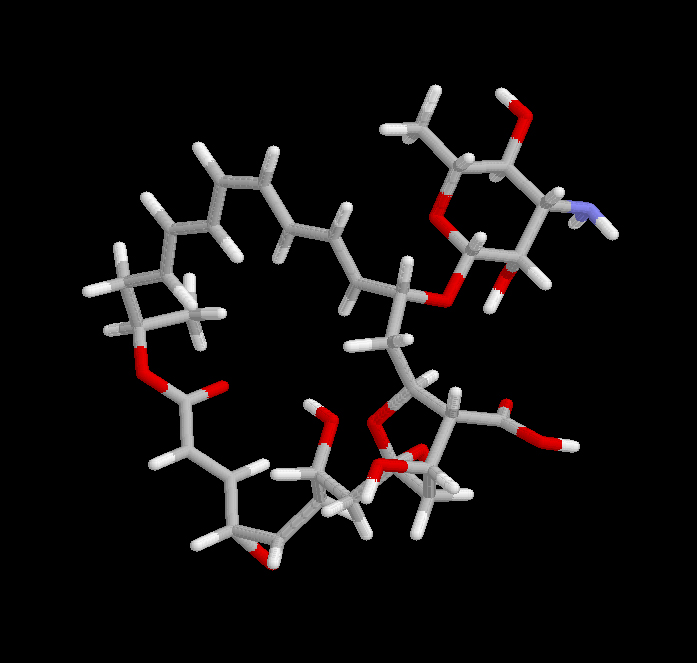
Natamicina
Otros conservantes
En el listado de aditivos alimentarios de la Unión Europea, aparecen también como conservantes:
Tiabendazol, E 233
Hexametilentetramina, E 239
Formaldehido, E 240
Dimetildicarbonato, E 242
Acido bórico, E 284
Tetraborato sódico, E 285
Anhidrido carbónico, E 290
Hexametilentetramina
Con la excepción del anhídrido carbónico, estos conservantes prácticamente no se utilizan, por razones toxicológicas, salvo en algunos productos muy concretos y de elaboración especial. La hexametilentetramina se utilizó en el siglo XIX para la conservación de la leche, mezclada con agua oxigenada, aplicación actualmente ilegal. En disolución en medio ácido se descompone, produciendo formaldehido, que es el componente activo. El formaldehido está reconocido como un potencial agente cancerígeno.
El dimetildicarbonato se ha utilizado como desinfectante, más que como conservante, para combatir las levaduras en bebidas. Con contaminaciones bajas, mata a estos microrganismos cuando se utiliza a concentraciones del orden de 100 ppm o menos. En disolución acuosa se descompone con rapidez, en metanol y CO2por lo que cuando el producto llega al consumidor no debería contener residuos del conservante como tal.
El ácido bórico y el tetraborato sódico (borax) se utilizan legalmente solamente en algunos países en la conservación del caviar. Sin embargo, se utiliza también algunas veces, de forma totalmente ilegal, para evitar el oscurecimiento de los crustáceos. El tiabendazol es un antifúngico utilizado en la protección externa de frutas como las naranjas y plátanos.
 Volver a Bioquímica de los Alimentos
Volver a Bioquímica de los Alimentos
 Volver a Aditivos alimentarios
Volver a Aditivos alimentarios












 Volver a Bioquímica de los Alimentos
Volver a Bioquímica de los Alimentos
 Volver a Aditivos alimentarios
Volver a Aditivos alimentarios