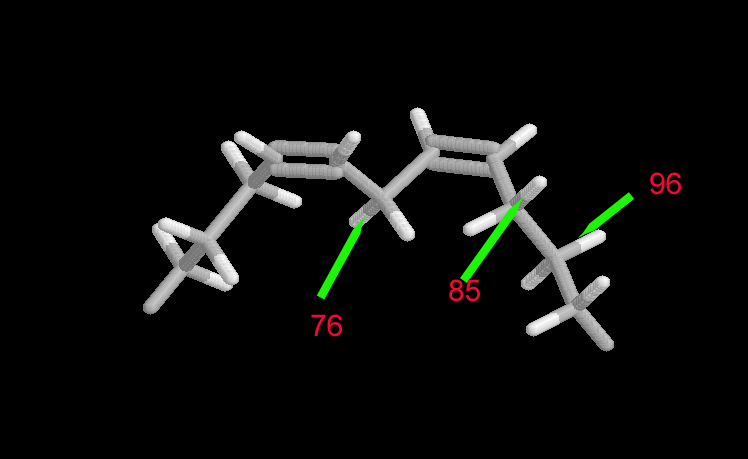
Energías de enlace C-H en una estructura insaturada, en Kcal/mol
|
BIOQUIMICA DE LOS ALIMENTOS Miguel Calvo |

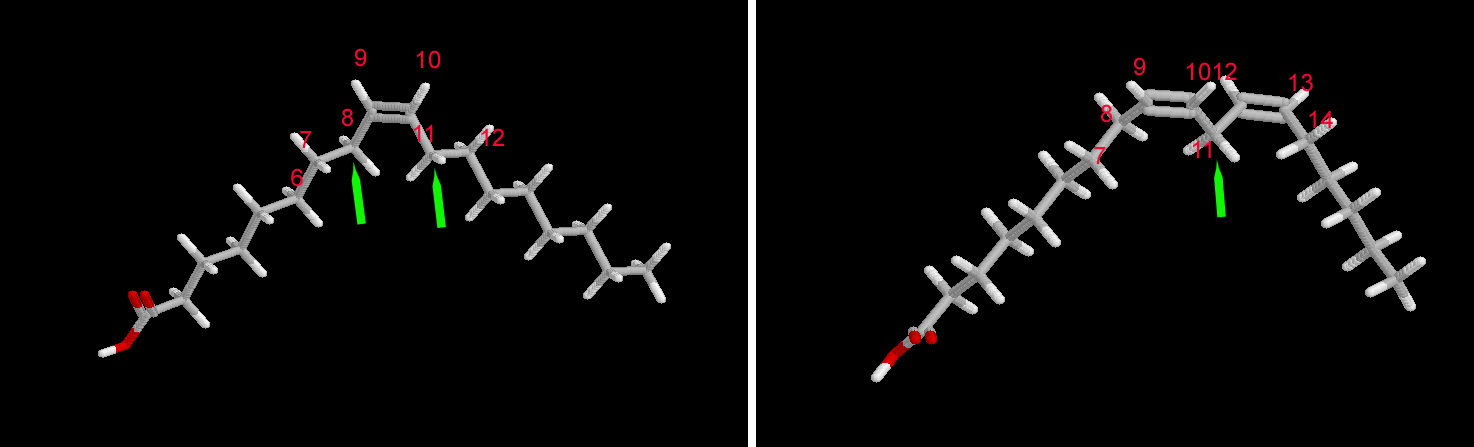
| Ácido graso | Posición del hidroperóxido | Proporción % |
| Ácido oleico | C8 | 26-28 |
| C9 | 22-25 | |
| C10 | 22-24 | |
| C11 | 26-28 | |
| Ácido linoleico | C9 | 48-53 |
| C13 | 48-53 |
 Volver a Alteración de los lípidos
Volver a Alteración de los lípidos