|
BIOQUIMICA DE LOS ALIMENTOS
Miguel Calvo
|
TIROSINASA
TIROSINASA
Introduccion
El pardeamiento enzimático es una reacción de oxidación en la que interviene como substrato el oxígeno molecular, catalizada por un tipo de enzimas que se puede encontrar en prácticamente todos los seres vivos, desde las bacterias al hombre. En el hombre es la responsable de la formación de pigmentos del pelo y de la piel. En los cefalópodos produce el pigmento de la tinta, y en los artrópodos participa en el endurecimiento de las cutículas del caparazón, al formar quinonas que reaccionan con las proteínas, insolubilizándolas. En los vegetales no se conoce con precisión cual es su papel fisiológico.
El enzima responsable del pardeamiento enzimático recibe el nombre de polifenoloxidasa, fenolasa o tirosinasa, en este último caso especialmente cuando se hace referencia a animales, ya que en ellos la tirosina es el principal substrato. También se ha utilizado el término cresolasa, aplicado a la enzima de vegetales. Se descubrió primero en los champiñones, en los que el efecto de pardeamiento tras un daño mecánico, como el corte, es muy evidente.

Champiñones cortados, mantenidos a temperatura ambiente y fotografiados a distintos tiempos.
En el campo de los alimentos, el pardeamiento enzimático puede ser un problema muy serio en frutas, champiñones, patatas y otros vegetales, y también en algunos crustáceos, e incluso en la industria del vino, al producir alteraciones en el color que reducen el valor comercial de los productos, o incluso los hacen inaceptables para el consumidor. Estas pérdidas son muy importantes en el caso de las frutas tropicales y de los camarones, productos trascendentales para la economía de muchos países poco desarrollados.
A pesar del nombre genérico de “pardeamiento” (“browning” en inglés), los colores formados son muy variables, marrones, rojizos o negros, dependiendo del alimento y de las condiciones del proceso. En algún caso, como en las pasas, otras frutas secas, la sidra, el té o el cacao, el pardeamiento enzimático contribuye al desarrollo de los colores característicos de estos productos, aunque como se ha indicado, en otros muchos constituye un problema grave. Además de la alteración del color, los productos formados pueden reaccionar con las proteínas, insolubilizándolas. Por otra parte, puede producirse también una pérdida nutricional, ya que aunque la polifenoloxidasa no oxida directamente al ácido ascórbico, esta vitamina puede destruirse al reaccionar con intermedios de la reacción.
Estructura de las polifenoloxidasas
La polifenoloxidasa, EC 1.14.18.1 tiene dos actividades enzimáticas, una hidroxilando monofenoles (“cresolasa”) y otra oxidando difenoles a quinonas (“catecolasa”). Dependiendo de la fuente, la actividad “cresolasa” es mayor o menor, incluso inexistente en algunos casos. En cambio, todas las enzimas tienen actividad “catecolasa”.
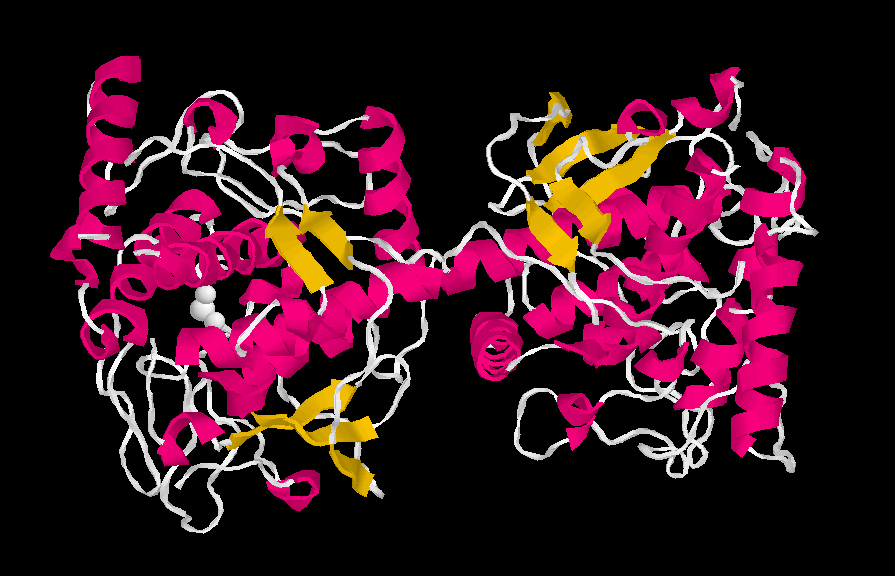
Estructura de la polifenoloxidasa de la batata.
En el dominio de la izquierda se muestran los átomos de cobre de cada centro activo, con una molécula de oxígeno unida
La característica estructural más importante de estas enzimas es la presencia en su centro activo de dos átomos de cobre, unidos cada uno de ellos a tres histidinas, que se han conservado a lo largo de la evolución en todas las enzimas de este tipo, desde las bacterias al hombre. En su entorno se sitúan una serie de aminoácidos hidrofóbicos, con anillos aromáticos, que también son importantes en su actividad, para la unión de los sustratos.
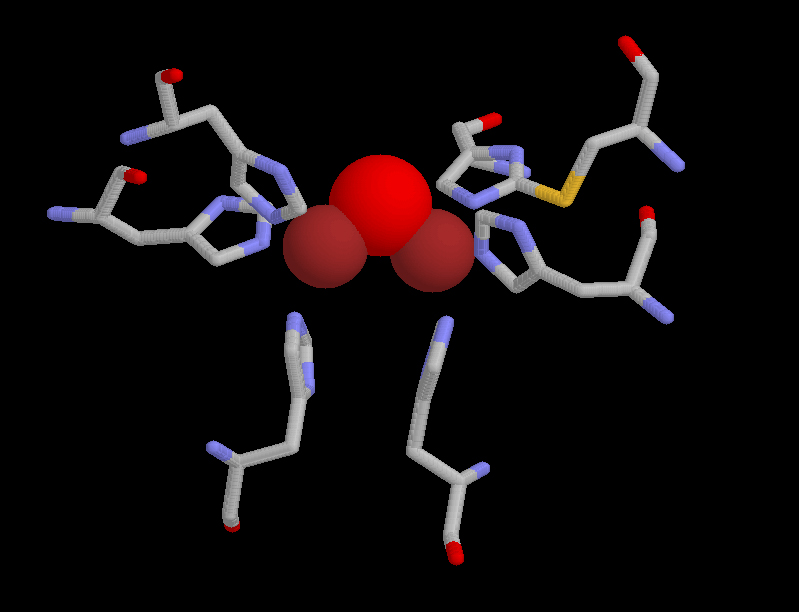
Estructura del centro activo de la polifenoloxidasa.
La forma de actuación del enzima, con dos actividades distintas, ha sido un misterio, aclarado en parte hace relativamente pocos años. El enzima cataliza dos reacciones porque en el estado nativo se encuentra en dos formas distintas, la llamada met-tirosinasa, que es activa solamente sobre monofenoles, y la oxi-tirosinasa. Estas formas se interconvierten entre ellas, de forma acoplada al desarrollo de la reacciones que catalizan.
En los crustáceos (y en los insectos), la polifenoloxidasa se encuentra en forma de proenzima, inactiva, que es activada por proteolisis por una proteasa endógena. Diversas sustancias producidas por microrganismos activan la proteolisis del proenzima y la formación de enzima activo.
La reacción de pardeamiento enzimático
El pardeamiento enzimático es un conjunto complejo de reacciones, que se inicia por la o las reacciones catalizadas de forma enzimática.
La primera de ellas, cuando el sutrato presente es un monofenol, es su transformación en difenol. La segunda, la transformación del difenol en quinona. En el caso de la tirosina (monofenol) se forma primeramente la dopa (difenol) y luego la dopaquinona (quinona).
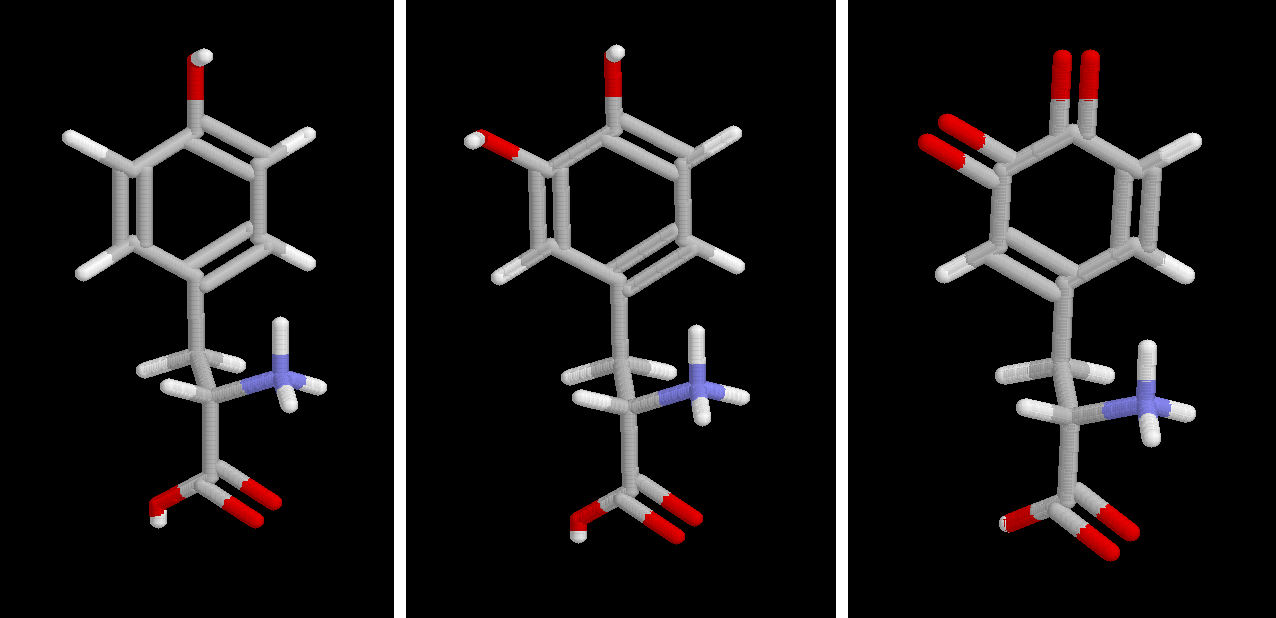
Tirosina, DOPA y DOPA-quinona
A partir de la formación de la quinona, la reacción progresa de forma espontánea, de una forma que depende del substrato concreto. En algunos casos las quinonas se pueden convertir en trifenoles por reacción con el agua, y posteriormente oxidarse a hidroxiquinonas. Todas estas sustancias son muy reactivas, dando lugar a polímeros y reaccionando con otras sustancias presentes en el alimento, especialmente proteínas. Es importante su capacidad de reacción con grupos -SH. Los productos finales, llamados melaninas, son de color muy oscuro, o negro, e insolubles en agua. Estos polímeros tienen propiedades antimicrobianas, y prodrían ser un mecanismo de defensa de los vegetales contra infecciones.
Substratos
Los sustratos de la reacción pueden ser monofenoles o difenoles. La tirosina es el sustrato principal de la polifenoloxidasa en los crustáceos, y también se encuentra presente en vegetales como la lechuga o en los champiñones.
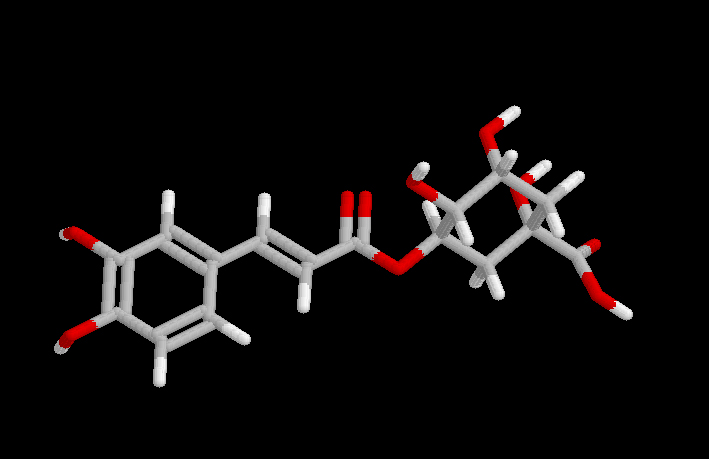
Ácido clorogénico
En los vegetales, el sustrato más extendido es probablemente el ácido clorogénico, en el que el grupo fenólico se encuentra unido a un resto de azúcar, que se encuentra, entre otros, en manzanas, peras, melocotones, ciruelas, uvas, aguacates y patatas. En algunos vegetales se encuentran además DOPA, dopamina, p-cresol, ácido cafeico y otros fenoles.
Las polifenoloxidasas son también en muchos casos capaces de oxidar aminas aromáticas para formar o-aminofenoles.
Control de la reacción de pardeamiento
El control natural de la actividad de la polifenoloxidasa se produce fundamentalmente mediante la compartimentalización de los sustratos. El enzima se encuentra en los plástidos y cloroplastos (en los vegetales superiores), y también en el citoplasma celular, mientras que los compuestos fenólicos que pueden servir de sustratos se acumulan en vesículas. Cuando se rompe la compartimentalización por un daño mecánico,como el triturado, corte o congelación y descongelación, la reacción de pardeamiento se puede producir. También se produce la inhibición del enzima por los productos de la reacción.
Además de manteniendo la compartimentalización, la reacción de pardeamiento se puede frenar actuando sobre diferentes factores:
Evitando el contacto del oxígeno con la superficie de corte
Bajando al temperatura
Reduciendo el pH
Desnaturalizando el enzima
Generalmente estos factores actúan de forma combinada. Así, el descenso de pH puede actuar inicialmente reduciendo la actividad del enzima, (su pH óptimo está entre 5 y 7), pero también, si es suficientemente bajo, desnaturalizándola de forma irreversible.
Los reductores pueden actuar de varias formas, entre ellas revertiendo la reacción de quinonas a fenoles. También pueden actuar directamente sobre el centro activo del enzima, transformando el cobre 2 en cobre 1, que se disocia más fácilmente. El sulfito y la cisteína, además de reaccionar con las quinonas reduciéndolas a difenoles, inactivan el enzima.
Los sulfitos presentan el problema de su toxicidad diferenciada para algunas personas, un pequeño porcentaje de los asmáticos, que pueden sufrir crisis severas con cantidades incluso inferiores a los límites legales. Consecuentemente, existe una tendencia a reducir la utilización de sulfitos, aunque no siempre es posible.

Oscurecimiento de la cabeza de un langostino por acción de la polifenoloxidasa. Aunque esta reacción no tiene efectos nutricionales ni sanitarios, degrada mucho la calidad visual del producto, y su valor comercial
Un inhibidor muy eficiente la la actividad de la polifenoloxidasa de los crustáceos es el ácido bórico, aunque actualmente está prohibido su uso, dados los riesgos de toxicidad. Se utilizan sulfitos.
El ácido ascórbico, es un inhibidor de la reacción muy eficaz en principio, al reconvertir las quinonas en fenoles, pero la inhibición es solamente temporal, al agotarse el ácido ascórbico con el transcurso de la reacción. Además, posteriormente puede ocasionar problemas, ya que el dehidroascórbico formado puede dar lugar a una reacción de pardeamiento específica. Dependiendo de las condicioes de uso, el ácido ascórbico puede también destruir el enzima al modificar las histidinas del centro activo por reacciones mediadas por radicales libres.
Los agentes quelantes, capaces de eliminar los átomos de cobre del centro activo del enzima, y consecuentemente inactivarla, son inhibidores muy eficientes. Pueden utilizarse el EDTA, pirofosfato, y especialmente el ácido cítrico, que combina el efecto de la acidez con la capacidad secuestrante de metales.

Membrillo cortado, mantenido a temperatura ambiente. El de la derecha ha sido frotado con un limón, cuyo zumo contiene ácido cítrico.
La primera foto ha sido tomada inmediatamente tras el corte, la segunda una hora después y la tercera tres horas después.
Algunas otras sustancias, como el ácido benzoico y otros compuestos aromáticos, actúan reduciendo la actividad del enzima al competir con los sustratos. Y, por supuesto, la desnaturalización térmica, por ejemplo mediante escaldado con vapor, es un sistema muy eficaz, cuando puede utilizarse.
Otras enzimas relacionadas
Las lacasas (E.C. 1.10.3.2) son capaces de oxidar difenoles con los grupos OH en posición para. Estas enzimas tienen un centro activo semejante al de la polifenoloxidasa, también con iones de cobre unidos a histidina, pero el mecanismo de actuación es distinto. En la reacción se generan radicales libres, que pueden inducir otras reacciones de oxidación. Son glicoproteínas con un contenido importante de glúcidos, y generalmente son muy poco específicas en cuanto a substrato. Se encuentran en algunos vegetales superiores, pero sobre todo en algunos hongos fitopatógenos. Pueden representar un problema en el caso de contaminación de las uvas
 Volver a: Pardeamiento enzimático
Volver a: Pardeamiento enzimático








 Volver a: Pardeamiento enzimático
Volver a: Pardeamiento enzimático